Is, vand og damp
Et vandmolekyle består af tre atomer: 2 hydrogenatomer (H, nummer 1 i det periodiske system) og 1 oxygenatom (O, nummer 8 i det periodiske system). I vand bliver oxygen og hydrogen holdt sammen af kovalente bindinger. Det vil sige, at de deler elektroner, det gør bindingen stærk. Du kan se denne video for at lære mere om kovalente bindinger. Dog deler de ikke ligeligt: Et oxygenatom er 8 gange tungere end et hydrogenatom, derfor er dets tiltrækningskraft meget større. Det betyder at oxygenatomet vil have de negativt ladede elektroner meget tættere på, og man siger derfor at oxygen er mere elektronegativt.
Herunder er en figur der viser forskellige måder at vise et vandmolekyle:
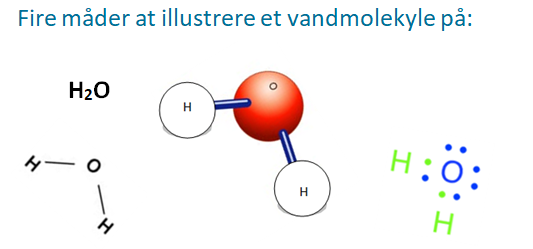
Når mange vandmolekyler er samlet, vil de danne et netværk, hvor plus polen finder sammen med minus polen. Denne tiltrækning kaldes hydrogenbindinger. Det gør at vand ”hænger godt sammen”, og vi har det, vi kalder ”vand”, som man ser i søer, have og på flasker.
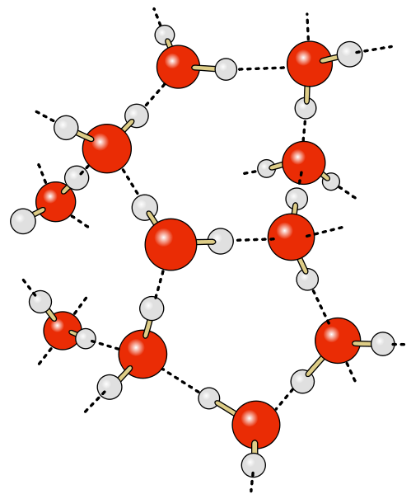
Hydrogenbindingerne betyder at vand har en stor overfladespænding, og det er derfor at man, med lidt forsigtighed, kan fylde et glas med så meget vand, at der danner en 'boble' op over glassets kant.
| Aktivitet: forsøg med overfladespænding |
|---|
Fyld et glas med vand, og undersøg overfladespændingen. Overfladespændingen gør, at vandet står højere i midten end ved glassets kant.
|
Tilstandsformer
Men vand findes også på andre måder, fx is og damp. De forskellige versioner af vand kaldes for tilstandsformer. Ved at ændre energien, enten i form af varme eller kulde, kan man ændre på tilstandsformen af vand. Hvis man koger vand, vil det blive til damp. Hvis man fryser vand, vil det blive til is. De tre tilstandsformer for vand (H2O) kaldes for: gas, væske og fast stof.
Hvis man tilfører energi til vandet, vil det nå sit kogepunkt. Energien får nemlig vandmolekylerne til at bevæge sig hurtigere, og så stiger temperaturen. Kogepunktet er den temperatur, hvor der er nok energi i vandet til at det går fra væske- til gasform. Når vand er blevet til gas, så fylder det meget mere, end når det er flydende. Hvis 1 liter flydende vand omdannes til sin gas form fylder det i stedet 1500 liter - man kalder det også damp eller vanddamp.
Hvis vandet køles ned, vil molekylerne bevæge sig langsommere, og når vandet når frysepunktet stopper molekylerne med at bevæge sig, og vi har fast stof - også kaldet is.
Vand er en af de eneste almindelige stoffer, som kan findes i alle tre tilstandsformer på Jorden.
| Lav dine egne forsøg |
|---|
Eksperimentarium har lavet et hæfte med masser af forsøg der handler om vands forskellige tilstandsformer. Find det her: "Vand, varme og energi" |
Normalt siger man, at mere energi (varme) et stof får tilført, jo mere vil det udvide sig - ligesom vi før hørte med vanddampen . Og jo mere energi man tage væk (varmetab), jo mere vil det trække sig sammen. Men, sådan er det ikke med vand.
| Se denne video og lær om dannelsen af iskrystaller og om fænomenet ‘underafkøling’ |
|---|
Vand udvider sig også, når det fryser. En isterning vil altid flyde ovenpå når den ligger i vand, fordi isens massefylde er lavere end vandet i væskeform. Dette skyldes at vand har en speciel egenskab, nemlig at det danner krystaller (iskrystaller) når det når frysepunktet. En krystal består af et ordnet netværk af molekyler – i modsætning til både væske og damp, som begge er kaotiske, og i begge tilfælde vil molekylerne sværme tilfældigt i mellem hinanden. Den ordnede krystalform gør at isen får en bedre flydeevne, men den gør også at vandet kommer til at fylder mere, end det gjorde på flydende form. Dette er årsagen til at man om vinteren kan risikere at lukkede vandrør med vand i springer, fordi der ikke er plads til isen i røret, da det fylder mere end vandet gjorde før.
Vand kan også være underafkølet. Det vil sige, at dets temperatur er under dets frysepunkt, men det er stadigvæk på væskeform. Det er fordi iskrystaller skal formes fra et startpunkt, som fx kan være en urenhed i vandet, der kan starte en krystaldannelse.
| Forsøg: Underafkøling |
|---|
Køb en flaske demineraliseret vand (0,5L) og nedkøl den (uåbnet) til -18 grader i en fryser. Dette skulle gerne tage mellem 1,5 til 2 timer. Vandet skulle nu gerne være underafkølet - dvs under frysepunktet men stadig på flydende form. Du kan nu skabe dit eget krystalliseringspunkt ved at slå til flasken (vandet skulle gerne fryse med det samme). Tips: åben ikke fryseren under kølingen og ryst ikke vandet for meget. Hvorfor tror du det er smart at lade være med at åbne flasken inden den køles ned? |
Tripelpunkt
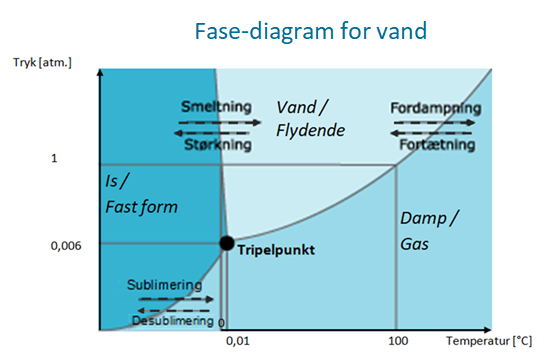
Tryk har også en indvirkning på vands tilstandsformer. Det kan man se på kurven herunder, som viser vands tilstandsformer samt vandets tripelpunkt.
| Aktivitet: Hvordan påvirkes damp/vand/is af tryk? |
|---|
Brug internettet til at forklare: Hvornår koger vand på toppen af Mt. Everest - og hvorfor? Hvornår koger vand på bunden af havet og hvorfor? Hvornår koger vandet på Mars - og hvorfor? |
Tripelpunktet bruges til at beskrive den temperatur og det tryk hvor vand befinder sig i alle tre tilstandsformer på en gang. Her vil små ændringer i tryk og temperatur forskyde balancen og du kan gå fra is til damp på nul komma fem. Eller fra vand til is på ingen tid.
Når vand går direkte fra fast form (is) til gasform (vanddamp) kaldes det for sublimering. Når processen går den anden vej - fra vanddamp til is, kaldes det for desublimering.
| Aktivitet: Få styr på faseovergangene |
|---|
Se på kurven vist herover med vands tripelpunkt. Overgangene mellem tilstandsformerne kaldes faseovergange. Forklar følgende faseovergange med hensyn til tyk og temperatur for vand - hvad sker der ved:
|